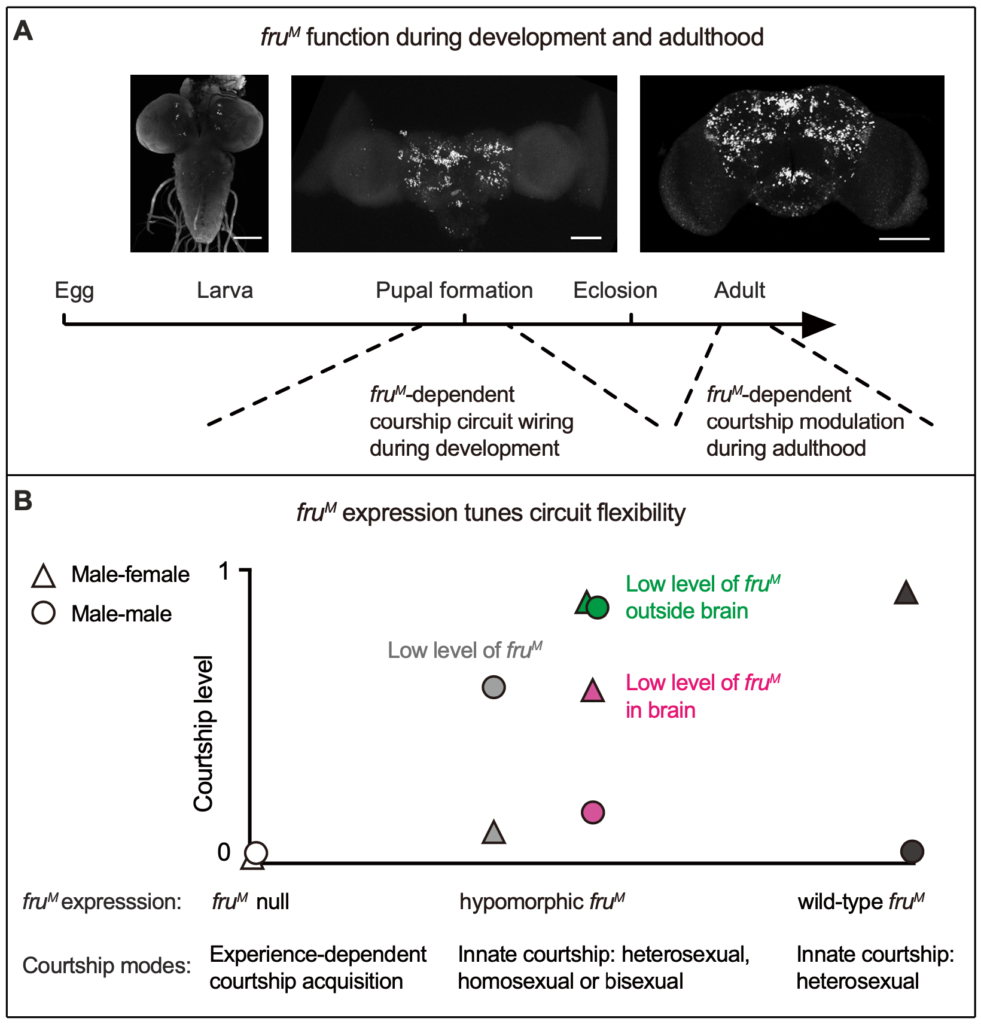
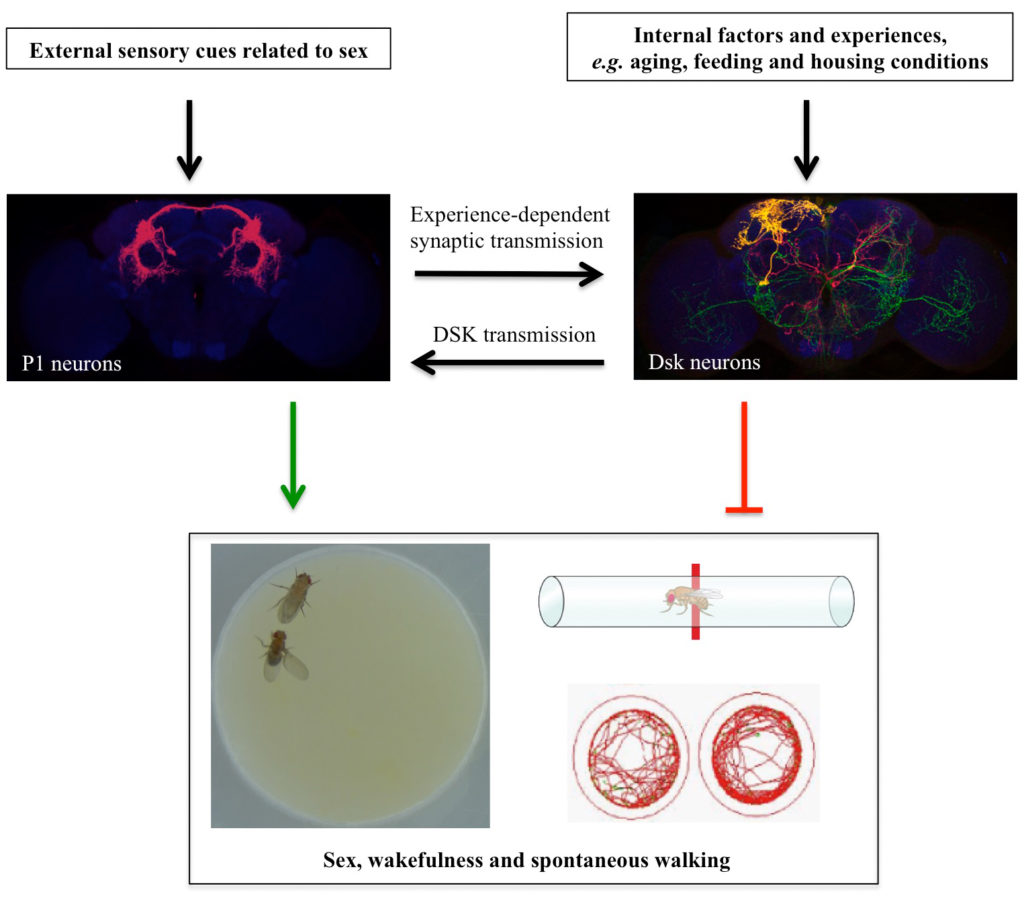
博士生孙梦实同学作为第一作者在Cell Reports杂志上发表研究论文“A neural pathway underlying hunger modulation of sexual receptivity in Drosophila females”,报道了雌蝇在饥饿状态下会更频繁的拒绝雄蝇求偶这一现象,并解释了调控这一行为的神经环路和分子机制。
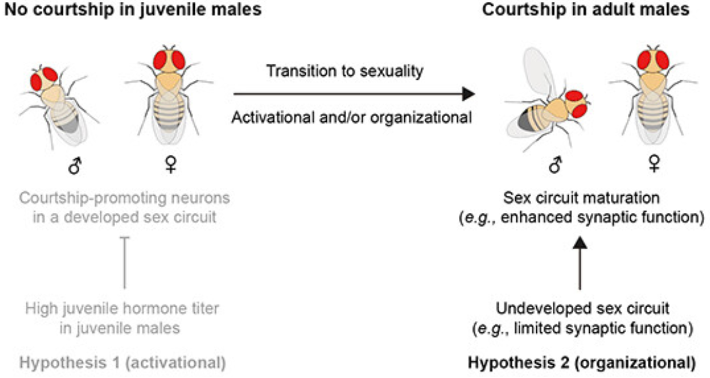
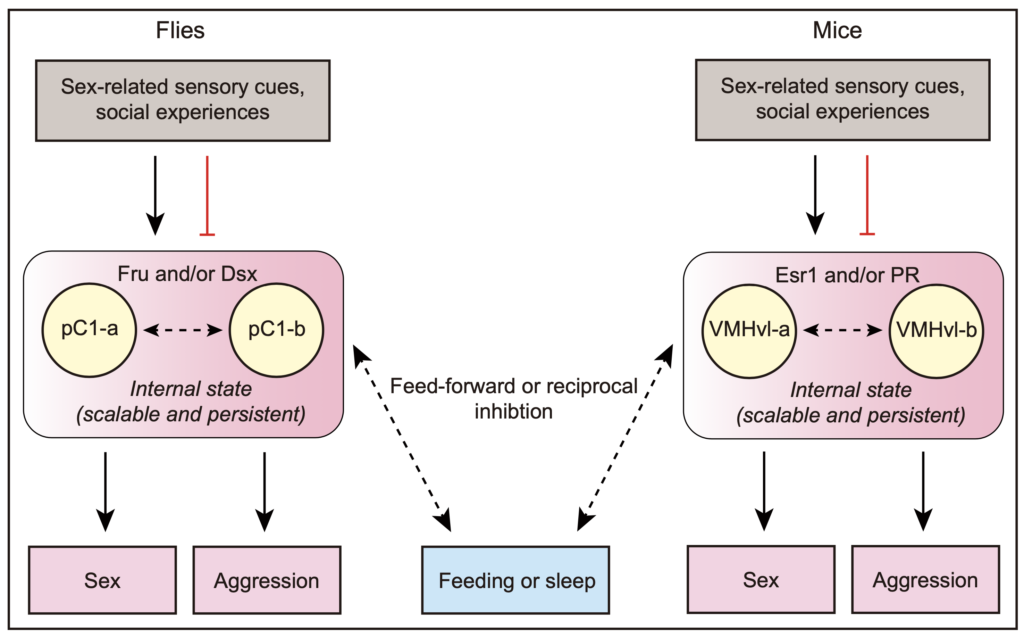
本能行为是指不需要后天学习、训练即可产生的行为。但在复杂的自然环境中,往往会在同一时间产生不同的本能需求,比如进食与求偶。本课题研究雌性果蝇在饥饿状态下的生殖行为,即当内在需求产生冲突时生物体会如何做出行为抉择。研究发现,经历过食物剥夺处理的雌蝇相较饱腹雌蝇会更少接受雄蝇的求偶,并且饥饿雌蝇会在雄蝇进行求偶时更频繁的跳离以拒绝雄蝇的追求,这一过程通过AkhR/Tdc2神经元发挥调控功能。Akh(Adipokinetic hormone,脂动激素)是胰高血糖素在果蝇中的同源物,饥饿状态下由果蝇心侧体释放,和果蝇脂肪体细胞的AkhR受体结合后促进细胞脂质代谢,恢复下降的血糖。除了脂肪体,果蝇的神经系统中也有AkhR的表达。实验发现,饥饿激活果蝇脑中的AkhR神经元,AkhR神经元再通过释放章鱼胺抑制雌蝇的接受行为。有意思的是,饥饿状态下,AkhR/Tdc2神经元会有更多的神经元投射,表现出饥饿诱导的神经元形态的可塑性。同时,该研究也鉴定到了AkhR/Tdc2神经元的下游AV4c2神经元。章鱼胺通过与其受体OA2结合并激活AV4c2神经元,并由其释放抑制性神经递质伽马氨基丁酸(GABA)抑制雌蝇的接受行为。通过电镜数据库比较,作者发现AV4c2神经元和生殖行为的中枢神经元pC1存在突触连接,并利用钙成像实验证明饥饿和AV4c2神经元都能抑制pC1神经元的钙活性,行为学结果也证明pC1神经元失活后,因饥饿引起的雌蝇接受行为下降这一表型消失。该研究还证明饥饿是通过影响pC1神经元中乙酰胆碱(ACh)的功能来降低接受行为。pC1神经元在之前的研究中已被证明是调控接受行为的一类中枢神经元,且能够整合嗅觉信息(比如信息素)、听觉信息(比如求偶歌)以及雌蝇的交配经验(是否已交配过)。该研究证实pC1神经元也能够整合雌蝇的内在营养状态从而调控其生殖行为。